
Előzetes megjegyzés: A következő fejezet teljes megértése bizonyos jártasságot igényel az elektrokémiában, bár az alapgondolatot a matematikai képletek nélkül is meg lehet érteni.
Az átdolgozott magyar változat megjelenési dátuma a www.eautarcie.org honlapon:
2010-02-25
Legutóbbi felfrissítése: 2015-07-29


A bioelektronika története és
tudományos bírálata

A redoxi tulajdonságok « pH-ja »: az rH
Clark tudományos inkvizíciós pere
1920-ban W.M. Clark az rH megalkotásával a korszerű elektrokémia kifejlődésének az egyik alapkövét tette le [1]. Amint azt már említettem, az rH és a jól ismert pH fogalma elválaszthatatlanok: egymást kiegészítik. Képzeljük mi lenne ma az általános-és analitikai kémia pH nélkül! Az rH « eltemetése » az elektrokémia fejlődésében számos ajtót bezárt, sajnos az orvostudomány terén is. Ha korában nem is állt minden adat a rendelkezésre, amiből elméletét levezethette volna, intuitív úton helyes eredményre jutott. Az rH biológiai kutatásokban azonnal nagyon hasznos eszköznek bizonyult és használata futótűzként terjedt el a világ legtöbb kutatóintézetében. Sajnos a korabeli tudományos szaktekintélyek számára. az új elmélet érthetetlennek bizonyult. 1920 és 1924 között, az American Chemical Society keretein belül az rH fogalma körül egy szenvedélyes vita alakult ki. Egy hónapot töltöttem a könyvtárakban az erre vonatkozó jegyzőkönyvek előkerítésére, elolvasására és tudományos elemzésére. 1924-ben Clark az rH elméletét, nyilvánosan visszavonta.
W.M. Clark, « The Determination of Hydrogen Ions », Baltimore Williams & Wilkins Co. (1920) Clark könyve 1924-ig több kiadásban megjelent.
Ettől függetlenül az rH alkalmazása annyira hasznos volt, hogy az Egyesült Államokon kívül, a tudományos világ a laboratóriumokban tovább alkalmazta. A két világháború között Franciaországban egy egész iskola alakult ki a fogalom elmélyítésére, aminek az egyik legjelesebb alakja Fred VLÈS, a Strasbourgi Egyetem tanára volt.
Mi volt a tudományos ellenérv ami az rH fogalmát félretette? Clark, mint nem igazi fiziko-kémikus helytelenül fogalmazta meg az rH definícióját. Szerinte az rH nem más, mint a vizes oldatban lévő hidrogén (H2) gáz nyomásának (PH2) a negatív logaritmusa:
rH = - log PH2
Csak így tudta megfogalmazni, mert akkor a termodinamikai aktivitás fogalma még ismeretlen volt. A valóság az, hogy vizes oldatokban általában nincs hidrogén gáz. Ezt viszont elméletének az ellenzői is tudták és nagy tudálékossággal kijelentették : « Ott ahol nincs hidrogén, ott rH sem lehet. Egy nem létező nyomás csak egy nem létező fogalmat határozhat meg! » Sajnos Clark más hibát is elkövetett: azt állította, teljesen helytelenül, hogy vizes oldatban az rH a feloldott anyag oxidáló vagy redukáló « erősségét » is meghatározza. Mintha most azt állítanánk, hogy egy oldat pH-ja meghatározza az oldott sav vagy bázis erősségét. A fent irt tévedések ellenére az rH és kizárólagosan az rH, valóban az oldott anyag és a víz közötti elektroncsere szintjét határozza meg. Csak ezt a tényt Clark kortársai nem értették meg és a francia közmondás szerint « a kisbabát is kidobták a fürdővízzel ».
Az rH, ill. az rH2 fogalmát az Egyesült Államokon kívül kb. 1950-1960-ig mindenütt használták. Különben az rH2 értékét a mért E redoxipotenciálból és a pH-ból a következő képlettel számítják ki:
![]()
Az rH2 kiszámításához gyakorlatban (25°C-on) a következő összefüggést használják:
rH2 = 33,8 E + 2 pH
...ahol E (Volt-ban mérve) az oldatba mártott platina elektróda potenciálja a standard hidrogén elektródához viszonyítva. A közvetlenül mért ORP (redoxipotenciál) értékéből az E potenciált a következő képlettel számítják ki:
E = ORP + ER
...ahol ER a méréshez használt referencia elektróda potenciálja. Ha az ORP méréséhez pl. ezüst-ezüst-klorid (Ag/AgCl) elektródát használnak, akkor ER = +0,2 Volt.
A számítás szemléltetésére vegyünk egy példát. Egy ivóvíz mintában Ag/AgCl referencia elektródával párosított platina elektródával a mért ORP érték – 150 mV = - 0,15 Volt. A víz pH értéke 7,5. Ebben az esetben a megvizsgált víz rH2 értéke:
rH2 = 33,8 E + 2 pH = 33,8(0,2 – 0,15) + 2x7,5 = 16,7
Az rH2 Egyesült Államokon kívüli használatát a « Vasfüggöny » léte is segítette. Nevezetesen Erdey-Grúz Tibor és Schay Géza Elméleti fizikai kémia c. több kötetes alapvető művének első kiadásaiban még van róla szó. A fizikai kémiai táblázatokban a redoxi indikátorok színváltási tartományát még rH2 (ill. rH, ami ugyanaz) értékekkel fejezték ki [2]. Az 1960 utáni kiadásokból eltűnik az rH és a redoxi indikátorok színváltási tartományát az rH helyett a redoxi potenciál értékekkel helyettesítették. Nem vették tudomásul azt a tényt, hogy míg az rH táblázatokban lévő értékek minden pH értéknél érvényesek, addig a redoxi potenciál értékek csak egyetlen egy pH értékre vonatkoznak. A táblázat elveszítette gyakorlati értékét.
Erdey-Grúz Tibor és Schay Géza, Elméleti fizikai kémia. (Tankönyvkiadó 1954) II. kötetének a 786. oldalán a X.35.-ös táblázatban a « Redoxi indikátorok színváltozási intervalluma » táblázatban ez az intervallum még az rH értékkel van meghatározva. A táblázat harmadik oszlopának az utolsó sorában azt is jelzik, hogy « az 1 mólos kénsavban (pH=0) a potenciál εo (ami az ORP) jóval magasabb: +0,83Volt », ugyanis a többi értéket pH=7 oldatokban mérték. Sajnos a szerzők nem jelzik azt a tényt, hogy az rH színváltozási intervalluma a pH értékétől független. Az rH2 « eltemetése » után a redoxi indikátorok színváltozási intervallumait a táblázatokban az ORP értékéhez kötik. Sajnos a jelzett értékek csupán egy bizonyos pH értékre érvényesek. Ezzel ezek a táblázatok gyakorlati értéküket elveszítették.
Mi történt 1950 és 1960 között? Az amerikai Bockris vezetése alatt kiadott Modern Electrochemistry c. hatalmas mű az elektrokémia bibliája lett. (J.O'M. Bockris, A.K.N. Reddy, « Modern Electrochemistry », Vol.2. Plenum New York [1970]). Ebben a könyvben Bockris az rH fogalmának megadta a « kegyelemdöfést ». Mint fiatal tudományos kutató, a ’60-as évek végén találkoztam több amerikai elektrokémikussal akiket a franciák által is használt rH rendkívül « idegesítette ». Ekkor még a franciák nagyon ragaszkodtak nyelvük nemzetközi tudományos használatához. A francia nyelv volt az utolsó akadály az angol nyelv elterjesztése előtt. Az rH « kivégzése » összefügg-e vagy sem az angol-francia nyelvhasználati versennyel azt én nem tudom, de Franciaország volt és maradt 1960-ig a bioelektronika utolsó fellegvára.
Mi volt a tudományos érv az rH eltávolítására majdnem 40 évvel Clark után? Bockris szerint az rH skálán a semlegességi, ill. indifferens pont az rH=28. Ez 10-28 mol hidrogén molekulát (H2) jelent literenként. Ez a koncentráció már a homeopátia tartományába tartozik. 10-28 mol/liter kicsiny érték, lehetetlenül kicsiny: egy oldott hidrogén molekula kb. 20.000 liter vízben. Bockris szerint ilyen mennyiségű hidrogén semmilyen körülmények között egy platina elektróda potenciálját meghatározni nem tudja. Tehát sem az rH, sem a franciák által nevezett rH2 nem létezik. Ezzel a vita, lezárult.
Louis-Claude VINCENT, az orvosi bioelektronika atyja
Érdekes megjegyezni, hogy az orvosi bioelektronika pontosan az ötvenes években született akkor, amikor tudományos körökben már az alapjait (az rH2 fogalmát) elvetették. Louis-Claude VINCENT-t tekintik általában a megalapítójának. Különben Franciaországban a bioelektronikát a BEV rövidítéssel jelölik meg, aminek a teljes jelentése Bio-électronique Vincent. Vincent mint vízügyi mérnök Libanonban dolgozott, ahol a franciák városi vízelosztó berendezéseket helyeztek el. Ebben a földközi tengeri országban jó minőségű ivóvíz hiányában a lakosság körében a fertőző betegségek igen gyakoriak voltak. A franciák klórral fertőtlenített vízzel remélték ezeket az egészségi problémákat megoldani. A központi vízelosztó berendezések szolgálatba helyezése után a fertőző betegségek valóban lassan háttérbe szorultak. Az eltűnt fertőző betegségeket az évek folyamán más jellegű betegségek váltották fel. A kitört gyermekbénulási járvány nagy izgalmat okozott a helyi orvosi körökben. Megfigyelték azt is, hogy a leukémia, a trombózis és a rákos megbetegedések és az allergia is egyre gyakoribbá váltak ott, ahol azelőtt ezekkel a betegségekkel alig találkoztak. Az influenza és a nátha is járványszerűvé nőtte ki magát. A helyszínre hívott francia orvosokkal Vincent arra a következtetésre jutott, hogy valami összefüggés lehet a vízben lévő klór és az új betegségek között. Vincent a klór oxidáló tulajdonságaiban kereste és találta meg az okot. Rendkívüli intuícióval megsejti, hogy a vizes oldatok biológiai tulajdonságait az elektromos részecskék egyensúlya határozza meg. A vízben lévő hidratált proton H+ (amelyik H3O+ lesz) és a redukáló anyagokból származó elektron e- egymás hatását kiegészítik. Ehhez járulnak még hozzá az oldott elektrolitokból származó kationok és anionok. A proton egyensúlyokat a pH, az elektron egyensúlyokat az rH2, az ionerősséget pedig az oldat elektromos ellenállása ρ (ejtsd « ró ») jellemzi. Elég ezt a három tényezőt egy térbeli koordináta rendszer tengelyeire felvinni és megszületik a háromdimenziós Vincent-féle diagramm.
Franciaországba hazajövet Vincent-t valósággal ünnepli a helyi tudományos világ. Katedrát kap egy párizsi egyetemen és kutatásait folytatja. Különböző kórházakban a bioelektronikai mérések ezreit végzik el betegeken és egészséges személyeken is. Vincent kiegészíti elméletét a nevét viselő « energetikai tényezővel », a W-vel. Itt is intuitív módon megsejtette, hogy az élő szervezetekben az energiát termelő biokémiai folyamatokat egy oxido-redukciós elem termodinamikai tulajdonságaival lehet, mint működési modellt ábrázolni. Ő sem volt elektrokémikus, így a modelljét nem tudta kellően tudományosan bemutatni. Ezzel szemben a W az orvosi gyakorlatban a bioelektronikai egészség-mérleg fontos és igen hasznos eleme lett. Eredeti fogalmazása szerint ez a tényező:
![]()
Ahol k egy állandó, aminek az értéke 1 cm²/cm. E a vizes oldat redox potenciálja, ρ pedig a fajlagos elektromos ellenállása. Ha E-t millivoltban és ρ-t ohm.cm-ben fejezik ki, akkor W-t mikrowattban (µW) kapjuk. Vincent sem tudta megmagyarázni, hogy a W tényező miért határozza meg az energiatermelést, de mint tapasztalati (empirikus) tényező, igen hasznosnak bizonyult.
Sikereinek teljében Vincent egy lélektani hibát követ el. Kilép a tudományos kutatás köréből és igazának tudatában « hadat üzen » az akkor már igen nagy hatalommal rendelkező vízszolgáltató vállalatoknak. Nyilvánosan kijelenti, hogy az ivóvíz klórozása egy közegészségügyi ártalom. Nem vette észre, hogy a vegyi fertőtlenítés mögött álló, ekkor már fél évszázados pasteuri higiénikus elmélet, igen jelentős anyagi érdekek alapját képezi. Az amerikai kollégák ekkor végezték ki véglegesen Clark rH-ját, ami a Vincent-féle bioelektronikai elméletnek az egyik sarkköve. Ezt használták fel a korabeli francia kollégák Vincent tudományos « félretételére ».
Több, mint tíz évig tartó heves viták után a bioelektronika kiszorult a franciaországi kórházakból és az orvosi karokról. Közben Németországban is tért hódított, ahol még 1976-ban nemzetközi orvosi bioelektronikai kongresszust tartottak, aminek a tiszteletbeli elnöke Louis-Claude Vincent volt.
A belga tudósok szintén felfigyeltek Vincent tudományos munkáira. Tanulmányaimat az ULB-n, Université Libre de Buxelles-en végeztem, ahol egészen véletlenül az ULB egyik tanára Vincent-hez intézett levelének a másolata került a kezembe. POURBAIX professzor a következőket írja 1957 május 20-án:
« Szerintem is az elektróda potenciálokból kiszámított rH2 – pH tartományok nemcsak az élő szervezetekben lévő különböző anyagok stabilitását írják le igen jól, hanem a baktériumok, vírusok és hormonok létezési feltételeit is. Ezek a kísérletek alapvető fontossággal bírnak. Az egyensúlyi és kinetikai méréseket összevetve kell ezeket a kísérleteket elvégezni. »
Ha azt figyelembe vesszük, hogy a pH és rH2 egyensúlyi, viszont a W kinetikai tényező, itt Pourbaix [3] a bioelektronika egyik legszebb definícióját adja meg. Pourbaix így folytatja levelét:
« Végezetül még egy szót az elnevezésekről. Ön mindig rH2-ről beszél. Mi itt Belgiumban ezt rH-nak nevezzük és így definiáljuk: rH = -log[H2]. Ön is így határozza meg az rH2-t ? Azonnal megmondom, jobban szeretem az ön rH2 jelölését, mint a mi rH-nkat. »
Nem sokkal később, Pourbaix halálával, a belgiumi elektrokémia is felzárkózik az amerikai felfogáshoz és az rH2 elmélete lekerül a tanulmányi programokról. Louis-Claude Vincent egyedül marad. Még 1986 júniusában elfogadja a Journal de Bio-Électronique Vincent tiszteletbeli elnökségét és nem sokkal utána csalódottan, sok keserűséggel meghal [3].
Pourbaix ekkor az International Committee of Thermodynamics and Electrochemical Kinetics főtitkára volt. Nemzetközileg elismert szakember, aki az elektrokémiába a nevéről elnevezett E – pH diagramokat vezette be. Mellékesen megjegyezve, Pourbaix E – pH diagrammjaiban mindenütt jelenlévő egyenes ferde vonalak mindig egy bizonyos rH2 értékhez vannak kötve. Az rH2 fogalma egyetlen számadattal helyettesíti a lineáris E-pH egyenleteket. Itt is előtűnik az rH2 « eltemetésének » a tudományos ostobasága
A ’60-as években, mint doktoráló fiatal egyetemi tanársegéd egyáltalán nem foglalkoztam ezzel a vitával, ami akkor « magasabb szinten » történt. Az rH2 fogalmát, mint mindenki, én is « elfelejtettem » ill. félretettem.
A doktori dolgozatomat Lucie de Brouckère elektrokémikiai laboratóriumában készítettem az Université Libre de Bruxelles-n. Itt folytatták Pourbaix tudományos kutatásait. 1962-ben Lucie de Brouckère tudott Vincent munkáiról, és nem volt meggyőződve Bockris iskolájának az igazával. Viszont az rH2 mérésének a nehézségeit is ismerte. A korabeli platina elektródák csak jelentős kísérleti óvatossággal adtak ismételhető eredményeket. Tanárommal számos szakmai eszmecserém folyamán gyakran beszéltünk a sav-bázis és redoxi folyamatok összefüggéseiről. Lucie de Brouckère a vizes oldatok pH-jának a kiszámítására még a ’40-es évek végén egy általános érvényű egyenletet javasolt:
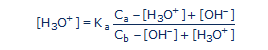
ahol Ca és Cb a sav és bázis analitikai koncentrációja, [H3O+] és [OH-] a hidrogén ionok (proton) és hidroxid ionok aktivitása. Kaa sav-bázis rendszer disszociációs állandója.
Lucie de Brouckère többször említette, hogy ennek a képletnek léteznie kell az redoxi folyamatok leírására is. 40 évig kereste, sikertelenül, de « érezte », hogy a két jelenség azonos természetű lévén, hasonló matematikai egyenletekkel írható le. Ez volt számomra tanítómesterem tudományos végrendelete.
Bár éveken keresztül nem foglalkoztam a témával, fejemben egy kis zugban megőriztem ezt a lehetőséget. A későbbiekben két, látszólag egymástól független, esemény vezetett vissza a témakörhöz. 1984-ben vagy ’85-ben, már nem emlékszem pontosan rá, egyik hallgatóm az Monsi Egyetem Orvosi karán egy látszólag elemi kísérleti problémával keresett fel. A vas II és vas III (Fe2+/Fe3+) redoxi rendszert kellett tanulmányoznia különböző koncentrációjú oldatok potenciáljának a mérésével. Egy sorozat kísérletben olyan potenciálokat mért, amelyek nem elégítették ki a Nernst féle egyenletet:
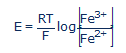
A vizsgálatkor kiderült, hogy a hallgató elfelejtette a vas III sót a mért oldatba bevinni. Így a vas III koncentrációja nulla volt: [Fe3+] = 0. Az ilyen oldatokat nem teljes (nem komplett) redoxi rendszerek néven ismerik. A hallgatót mulasztásáért rendreutasítottam és a kísérlet hibátlan megismétlését rendeltem elő, ami meg is történt. Néhány nap múlva az érdekelt újra felkeresett. Beismerte mulasztását, de nem értette azt a tényt, hogy nulla vas III koncentrációval a Nernst egyenlet értelmében meghatározhatatlan potenciált kellette volna mérnie, ugyanis amikor [Fe3+] = 0, a potenciál E, mínusz végtelen felé tart. Ezzel szemben nagyon is véges és reprodukálható potenciálokat mért. A kérdésére azt válaszoltam, amit minden kolléga válaszolt volna: a vas II oldatban mindig van vas III is, mint szennyező anyag, ami így a potenciált valamelyest meghatározza. Válaszom a hallgatót megnyugtatta, de engem nem. A kísérletileg mért potenciál értéke nem felelt meg egy feltételezett vas III szennyező koncentrációnak. A hibás kísérletet megismételtem és ekkor ez a tény világossá vált. Éreztem, hogy ezzel az esettel egy nagyon alapvető hiányosságot érintünk a hagyományos elmélettel kapcsolatban: a Nerns-féle törvény a nem teljes (nem komplett) redoxi rendszerek tulajdonságait nem a kísérleti eredményekkel összhangban írja le. Itt kilépünk a hagyományos elmélet alkalmazási tartományából. Ez még nem lenne baj, de a természetben és az élő szervezetekben lévő vizes oldatok túlnyomó többsége nem teljes redoxi rendszer. A teljes, a hagyományos az elmélet által leírt, rendszerek képezik a nagyon kevés kivételt a természetben.
Ennek ellenére a problémát még ekkor is félretettem. Nem foglalkoztam vele. Egy második esemény kényszerített a probléma újra felvételére.
Egy magánbeszélgetés folyamán egyik ismerősöm a Vincent-féle bioelektronikáról beszélt. Ekkor hallottam első kézből ennek a tudományágnak az orvosi alkalmazásairól, bár azelőtt is rendszeresen feltűnt ez a témakör a nagyközönségnek szánt sajtóban is, tehát tudtam róla. Nem tagadom, bizonyos fenntartással hallgattam szavait, ugyanis kollégáim az orvosi karról számos tudományos lepellel álcázott « kuruzsló » tevékenységről számoltak be. Első látásra a bioelektronika is ilyen tevékenységnek tűnt. Ezt ismerősömnek jeleztem is, amire ő kihívásképpen azt javasolta: bizonyítsam be tudományosan, hogy a bioelektronika hibás alapokon nyugszik. Elfogadtam a kihívást, ugyanis kíváncsi voltam az alapjaira, annál is inkább, hogy Vincent munkáit mesterem, Lucie de Brouckère professzor is elismerte, bár kísérleti fenntartásokkal.
Kértem tehát ismerősömtől egy könyvet, ami a témakörrel foglalkozik. Így jutott a kezembe Pierre Bressy La bio-électronique et les mystères de la vie (Le Courrier du Livre, kiadó, 1978) című könyve, amit nagy figyelemmel elkezdtem olvasni. A tervem az volt, hogy tudományos értekezést írok a témáról egy szaklap számára, s az értekezés elfogadása után több, a nagyközönségnek szánt folyóiratnak elküldöm az értekezés összefoglalóját.
Az első fejezetekben Pierre Bressy a Vincent féle bioelektronika (a továbbiakban az általánosan elfogadott BEV rövidítést fogom használni) tudományos alapjait ismerteti. Az első ötven oldalon már első, felületes olvasásnál, annyi tudományos hibát és helytelen megfogalmazást, definíciót találtam, hogy legszívesebben félredobtam volna a könyvet. Nem tettem meg. Pierre Bressy orvos lévén, nem fogalmazhatta meg helyesen az elektrokémiai fogalmakat. Ebből a gondolatból kiindulván, elhatároztam, hogy először kijavítom a hibákat – ha ki lehet – s a javított változat alapján írom meg a bíráló értekezést. Engem nem a fogalmazás hiányosságai érdekeltek, hanem a BEV tudományos alapja. Ez utóbbit akartam egyszer s mindenkorra « elintézni ».
Két hétig dolgoztam a hibák kijavításán, ügyelve arra, hogy a tudományos gondolat az eredeti formájában maradjon. Csak jóval később értettem meg, hogy ezt a fárasztó munkát előttem egyetlen szakember sem végezte el, mert nem vett rá fáradságot. Ahogy haladtam ezzel a munkával, egyre több igen érdekes összefüggésre lettem figyelmes, ami ugyan nem volt Pierre Bressy könyvében. A cáfolati stratégiát kidolgozva, döbbenve vettem tudomásul, hogy a helyesen megfogalmazott BEV tudományosan támadhatatlan. Minél jobban próbáltam az elméletet a legkisebb zugában is megérteni, hogy jobban leromboljam, annál inkább előtérbe lépett Louis-Claude Vincent alapgondolatának zseniális jellege. Éreztem, hogy itt a közvetlen orvosi alkalmazásokon túl az elektrokémia alapjait kell kiegészíteni.
Rávetettem magam a téma alaposabb vizsgálatára. Szerencsére volt rá időm. Ekkor szervezték át a tanszéket, ahol dolgoztam, s nekem egy külön laboratórium és független működési terület jutott. A hozzávaló irodalom felderítésére, heteket töltöttem több belgiumi egyetemi könyvtár polcai között. A tudományos munkát ott kellett újra felvenni, ahol Clark abbahagyni kényszerült, s ahol Vincent is megbukott. Tulajdonképpen Vincent, Clark formai tévedései miatt nem érvényesíthette elméletét.
Cáfolat helyett pontosan a BEV kijavított elméleti alapjait fogalmaztam meg. Hogy továbblépjünk, újra fel kellett venni Clark tudományos perét. Dolgozatomat ebben a szellemben írtam meg és 1986 júniusában a « Faut-il réhabiliter le rH2 de Clark? » címen a Société Française de Chimie L’actualité chimique c. folyóirat szerkesztőségének elküldtem. A válasz 1986 október 22-én érkezett meg, dolgozatomat a folyóirat nem közölte. A névtelen bíráló levelében érvelését arra alapozta, hogy : « Az elektroncserék szintjét vizes oldatokban kizárólagosan a redoxi potenciál E határozza meg ». Holott, mint ahogy azt a fentiekben jeleztem, az E értékét a protoncserés és elektroncserés reakciók együttesen határozzák meg. Ezt a következő alapvető egyenlet is igazolja:
![]()
![]()
Az egyenlet jobb oldalán lévő első tag csak a protoncserékre, amíg a második tag csak az elektroncserékre vonatkozik. Az E potenciál tehát két egymástól független mennyiség algebrai összege. A redoxipotenciál értékét tehát nemcsak az elektroncserék határozzák meg, hanem az oldat pH értéke is.
Clark perének a felvételére tett első kísérletem nem sikerült. A későbbiekben, dolgozatom többszöri átdolgozása után próbáltam megérteni ennek az elutasításnak az okait. Ha félre is tesszük dolgozatom bírálátban lévő hibákat, az ellenszenv szinte tapintható sorai között. Egy bizonyos mértékig én is éreztem ezt az ellenszenvet, amikor a BEV-ról először hallottam. Ha egy tudományos gondolat nem illeszthető a magunk által jól ismert rendszerbe, attól ösztönösen idegenkedünk, sőt első közelítésre elvetjük. Meg vagyok róla győződve, hogy ha bírálóm, félretéve első érzelmi indulatát, legalább egy fél napot szánt volna dolgozatom tanulmányozására, ő is rájött volna az elmélet figyelemreméltó méltó jellegére és nem utasította volna el.
Válaszlevelemben többek között egy igen egyszerű elektrokémiai feladatot adtam bírálómnak: számítsa ki a vegytiszta vízbe mártott platina elektróda potenciálját. Ha valaki nem ismeri az rH2 elméletét, ezt nem tudja megtenni. Viszont az elmélet segítségével ez egy elemi feladat. A kapott érték : 0,4 Volt a normál hidrogén elektródához viszonyítva, kísérletileg könnyen mérhető és reprodukálható.
Az rH2 elméletéről írt cikksorozatomat [4] csak négy év múlva közölte a Sciences du Vivant c. párizsi tudományos folyóirat. Ennek a munkának talán a legérdekesebb eredménye az rH2 kiszámítására javasolt általános érvényű egyenlet:
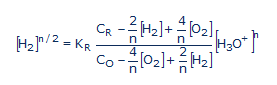 (1)
(1)
ahol [H2] és [O2] a hidrogén és oxigén aktivitása, [H+] a protonaktivitás, n a redoxi folyamatban kicserélt elektronok száma, CR és Co a redoxi rendszer redukált és oxidált formájának az analitikai koncentrációja. A KR a redoxi rendszer vízzel való reakciójának
Red + nH3O+ ![]() Ox +(n/2H2) + nH2O
Ox +(n/2H2) + nH2O
az egyensúlyi állandója:
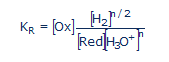
Az (1)-es sz. egyenletet kereste Lucie de Brouckère éveken keresztül, sikertelenül. A kijavított bioelektronikával megszületett a sav-bázis és redoxi reakciók egységes elmélete.
Még azt kellett megérteni, hogyan határozza meg egy homeopatikus koncentráció a platina elektróda potenciálját.
A négy dolgozat teljes szövege a jelen honlap „dokumentáció” oldaláról francia nyelven letölthető. Réactions d'oxydo-réduction et acido-basiques: vers une approche théorique et expérimentale plus cohérente; L'eau en tant que système rédox; Quelques aspects physicochimiques des coordonnées bio-électroniques; Concepts de base de la bio-électronique.
A hagyományos kettős-réteg elmélete
A hagyományos elmélet szerint egy vizes oldatba mártott fémes elektróda potenciálját a fém felületére adszorbeált ionok, ill. molekulák határozzák meg. Az rH2 méréséhez használt platina elektródára adszorbeált hidrogén H2 molekulák egy elektromos kettősréteget alkotnak, mint a töltések egy kondenzátor lemezén. Ennek az elektromos kettősrétegnek a kapacitása határozná tehát meg a potenciált.
Ha ez minden esetben így van, akkor az rH2 fogalmának valóban nincs fizikai értelme. Tiszta vízben a hidrogén H2 koncentráció gyakorlatilag nulla. Ilyen koncentráció nem alkothat elektromos kettős-réteget, tehát a platina elektróda potenciálját sem határozhatja meg. Ezen elgondolás szerint az rH2 valóban nem létezik.
A BEV elvetésének ez a tudományos alapja.
A hagyományos elmélet és a kísérleti tények
A korszerű elektrokémia a kettős-réteg elméletére épül. Mint minden elméletnek, ennek is meg vannak az érvényességi határai, amit a kísérleti megfigyelések határoznak meg. 10-3 mol/l feletti koncentrációknál valóban elképzelhető az elektromos kettősréteg kialakulása. Igen alacsony koncentrációknál viszont nem. Amikor az oldatban nincs elegendő ion ami az elektródára adszorbeálódhat, elektromos potenciált a hagyományos elmélet szerint nem lehetne mérni. A gyakorlatban ez nem így van. A platina elektróda potenciálja még a vegytiszta vízben is egy jól meghatározott és reprodukálható érték, ami +400 ± 10 mV a normál hidrogén elektródához viszonyítva.
A hagyományos kettősréteg elmélet ezzel a kísérleti eredménnyel nem tud mit kezdeni; sok más megfigyeléssel sem.
Nagyon tanulságos elektrokémikiai szakértőknek a következő feladatot adni: « Számítsa ki a vegytiszta vízbe mártott platina elektróda potenciálját. » Ez a feladat idegessé teszi az érdekelteket. Rövid gondolkodás után a válasz egyértelmű : « ilyen potenciál nem létezik ».
Az a legérdekesebb, hogy még az előttük lemért potenciál létezését sem ismerik el, mert az általuk ismert elmélettel nem magyarázható. Ezek után azt még hajlandók elismerni, hogy az rH2 csak egy elméleti fogalom, amit két kísérletileg mért értékből a platina elektróda potenciáljából és a pH-ból számítanak ki, de ez még létezését nem igazolja.
Kollégákkal való beszélgetés közben egyszer azt kérdeztem tőlük:
« Tegyük fel, hogy pontosan a nem létező, ill. a nagyon alacsony hidrogén koncentráció miatt az rH2 valóban csak egy nem létező elméleti nagyság. Ezzel szemben létezik-e a gyengén oldódó sók ion szorzata? »
Ez a kérdés kollégáimat idegessé teszi, ugyanis ezek az ion szorzatok minden kézikönyvben táblázatokba vannak foglalva. Emlékezzünk rá, az rH2 létezését a 10-28, vagy 10-32 -s igen kicsiny koncentrációk miatt nem ismerik el. Viszont a fent említett táblázatokban, többek között, a következő értékeket olvashatjuk:
- Higany szulfid (HgS) Ks = 4.10-53
- Higany szelénid (HgSe) Ks = 10-59
- Ezüst szulfid (Ag2S) Ks = 6.10-50
Ezek az ionszorzatok olyan alacsony ionkoncentrációnak felelnek meg, ami olyan nagyságrendű, vagy még kisebb mint egyes rH2 értékekhez tartozó hidrogén koncentráció, ill. aktivitás.
A kollégák válasza elég furcsa: « Ezeket a Ks értékeket nem analitikai mérésekből, hanem elektromos potenciálokból számították ki. Ezek az ion szorzatok tehát egy valós állapotot tükröznek ». Az rH2-t is mért potenciálokból számítják ki. Ez utóbbi akkor miért nem felel meg a valóságnak? Ezzel a gondolatmenettel a pH-t is « nem létező » nagyságnak kellene kinyilvánítani, miután ezt a nagyságot is két elektróda (az üveg- és referencia elektróda) potenciál különbségéből számítják ki. Itt tehát szemmel láthatóan azonos megfigyelésekre két különböző mércét használnak.
A fenti és az ehhez hasonló eszmecsere felettébb zavarba hozza a tudós kollégákat. Ezek után a végső érv az egymástól független kísérleti eredmények összhangja marad. Az elektrokémiai úton mért pH értékeket oldhatósági analitikai kísérletekkel lehet igazolni. Az rH2-t más természetű kísérletek igazolják-e?
Az rH2 elméletével a vegytiszta vízben mért potenciálból a víz képződésének a szabad entalpiáját is ki lehet számítani. A kísérletileg mért E=0,4 Volt potenciálból a Nernst-féle képlet így írható fel:
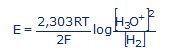
ahol R=8,314 J/mol.K, T=298K, n=2, F=96500 Cb/mol, a hidrogén ion koncentráció a vízben [H3O+]=10-7. Írjuk be ezeket a számértékeket a fenti egyenletbe:
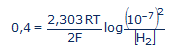
Ebből az egyenletből kiszámítható a tiszta víz hidrogénaktivitása: [H2]= 3.10-28 avagy az rH2 = - log [H2] = 27,5. Ezt az értéket 28-ra szokás kikerekíteni, ami a redoxireakdók semlegességi (indifferens) pontjának az rH2 értéke. Ezt az értéket be lehet vinni a víz bomlási egyenletébe:
2H2O ![]() 2H2 + O2 ,
2H2 + O2 ,
aminek az egyensúlyi állandója Ke = [H2]2[O2]. Ha tudomásul vesszük azt a tényt, hogy a víz összetételéből kifolyólag [H2]=2[O2], tehát az oxigénaktivitás [O2] a hidrogénaktivitás fele, [O2]=1,5.10-28, megkapjuk az egyensúlyi állandó értékét : Ke = 1,4.10-83.
Írjuk le most a víz keletkezésének az egyenletét:
H2 + ½ O2 ![]() H2O,
H2O,
aminek az egyensúlyi állandója K = [H2][O2]1/2
Könnyen kimutatható, hogy K = Ke-1/2 = (1,4.10-83)-1/2= 2,7.10-41.
Ebből már a víz képződési entalpiáját könnyedén kiszámíthatjuk a következő termodinamikai képlettel:
ΔG°298 = - RT ln K = - 8,314 x 298 ln 2,7.10 -41 = - 231,4 kJ/mol
A víz standard entalpiáját ΔG°298-t másrészt a hidrogén égéshőjéből, kalorimetriás mérések alapján számítják ki. Az így nyert érték: ΔG°298 = - 237,1 kJ/mol. Tehát a tiszta víz rH2-éből, és kalorimetriás mérésekből számított értékek közötti eltérés nem haladja meg a 2,5 %-ot. Sok kalorimetriás mérés hibahatára e fölött van. A kalorimetriás- és az elektrokémiai mérések a hibahatárokon belül azonos értékeket adnak. Ezzel szemben a kevésbé oldódó sók ionszorzatait analitikai mérésekkel eddig még nem igazolták, mert a mérendő koncentrációk a készülékek érzékenységi határai alatt vannak.
A fent leírt bizonyítás után mi utal arra, hogy az rH2 nem tükröz egy fizikai valóságot?
Miért nem vizsgálják felül Clark tudományos perét?
Elegendő tudományos adat áll már rendelkezésre, ami a per felvételét indokolná. Ez eddig még nem történt meg. Talán a legfőbb ok a vezető tudományos szakemberek szellemi rugalmatlansága. A BEV több, igen alapvető tudományos fogalmat helyez egészen új megvilágításba. Megértéséhez nyitott hozzáállás és egy kis figyelem is kellene.
Ha az orvosi alkalmazásoktól el is tekintünk, a BEV az elektrokémiában merőben új kutatási területeket nyitna meg. Egyik ilyen terület a nem teljes redoxi rendszerek tanulmányozása. Az ilyen rendszerek rH2-jét a koncentráció logaritmusának a függvényében lehet ábrázolni. A kapott függvényből egy standard redoxi potenciál is meghatározható. Egy redoxi rendszer oxidált és redukált formájához így két különböző standard redoxi potenciál E0adódik, ami a jól ismert termodinamikai érték felett és alatt van. Az új értékek segítségével könnyedén meg lehet magyarázni a reakciók hiányát olyan rendszerek között, amelyeknek termodinamikailag reakcióba kellene lépniük. A mai elektrokémia csak az irreverzibilitás fogalmával tudja, nem kielégítően, magyarázni ezt a jelenséget. A probléma nyitja a redoxi rendszerek és a víz közötti kölcsönhatásban keresendő. Erre ad egy nagyon részletes, és matematikailag jól leírt választ a BEV.
Egy másik, nagyon alapvető kérdés a nemesfém (platina, arany, titán, stb.) elektródák potenciáljának a keletkezése. Nagyon híg oldatokban az elektromos kettős réteg nem keletkezhet, mert nincs elég oldott elektrolit, holott a potenciál itt is nagyon jól mérhető. Ha ez nem így lenne, nem lehetett volna meghatározni a nagyon kevéssé oldódó sók ionszorzatát. A válasz itt is az oldott anyag és a víz közötti kölcsönhatásban keresendő. Már nagyon kevés oldott anyag a víz polimer szerkezetét jelentősen megváltoztatja, különösen akkor amikor ionokról van szó. Ilyen híg oldatokban az elektróda potenciálját nem az elektromos kettős réteg, hanem a víz polimer szerkezete határozza meg. A polimer szerkezet az elektron mozgását a víz teljes tömegében lehetővé teszi, feltehetően egy láncreakció szerű mechanizmussal. Ez az új elmélet még matematikai megfogalmazásra vár. Az elmélet megfogalmazása után talán egy másik tudományos inkvizídós pert is újra fel kellene venni: a víz emlékező tehetségének a perét.
Feltehetően itt rejtőzik az orvosi alkalmazások újrafelvételének az akadálya. Az rH2 fogalmával belépünk a homeopatikus hígítások tartományába. Amíg csak orvosok foglalkoztak vele, a víz emlékező tehetségét csak közvetett, és vitatott kísérletekkel lehetett igazolni. Az rH2mérések mögött, bár homeopatikus tartományba eshetnek, nagyon jól megalapozott termodinamikai fogalmak sorakoznak. Itt a kutatót nem vádolhatják csalással, mert az egyszerű elektromos potenciált bárki mérheti és ellenőrizheti.
A BEV nemcsak a rák és más igen súlyos betegségek korai észlelését teszi lehetővé, hanem ezeknek a betegségeknek a hatásos gyógyítását is nagy mértékben elősegíti.
Vissza az előző honlap oldalra.




